Was ist eine Elektrolysezelle?
Eine Elektrolysezelle besteht aus zwei Elektroden und einem Elektrolyt, das sich in einem Gefäß befindet. Die negative
Elektrode ist bei der Elektrolyse die Kathode und die positive die Anode.
Eine Eletrolyse ist die Abscheidung von Ionen aus gelösten oder geschmolzenen Verbindungen, also aus dem Elektrolyt. Eine
Elektrolyse kann man auch als Redoxreaktion bezeichnen. Die Reduktion findet immer an der Kathode statt und die Oxidation
immer an der Anode. Anwendung findet die Elektrolyse beim Trennen von Salzen, Herstellen von Wasserstoff und Sauerstoff
oder auch beim Laden eines Akkus.
Als Beispiel verwenden wir die Zersetzung einer Zinkbromidlösung:
Als Elektroden verwenden wir in diesem Fall Graphit, da Grahit an der Reaktion nicht Teil
nimmt. Solche Elektroden nennt man auch inert. Alternativ zu Graphit kann man auch Platin verwenden.
Die Versuchsanordnung sieht dann so aus:
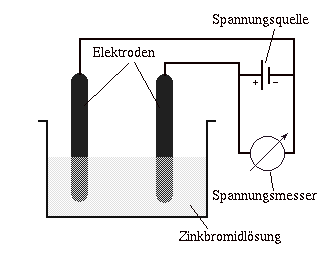
Die linke Elektrode ist die Kathode und wird mit dem negativen Pol der Gleichstromquelle
verbunden. Die rechte Elektrode ist die Anode und wird mit dem positiven Pol verbunden.
Schalten wir jetzt den Strom ein, so bemerken wir, daß sich an der Anode ein brauner Schleier bildet. Nach einiger Zeit
ist an der Kathode eine Metallabscheidung zu sehen und an der Anode steigen mittlerweile Blasen auf.
Entfernen wir jetzt die Stromquelle, stellen wir fest, daß zwischen den Elektroden immer noch eine Spannung besteht.
Was ist passiert?
In der Zinkbromidlösung befinden sich negativ geladene Bromidionen (Anionen) und positiv
geladenen Zinkionen (Kathionen). Die Anionen werden von der Anode angezogen und wandern dorthin. Deshalb heißen sie auch
Anionen (ionos (grch.) = Wanderer). Bei den Kathionen ist es genau umgekehrt.
An der Anode geben die Bromidionen ihre negative Ladung, also Elektronen an die Elektrode ab und werden zu Brom(aq)
. An der Kathode nehmen die Zinkionen Elektroden auf und gleichen so ihre positive Ladung aus. Sie werden zu
elementarem Zink.
Kathode: Zn2+ + 2e --> Zn Reduktion
Anode: 2Br- --> Br2 + 2e Oxidation
_____________________________________________
ZnBr2(aq) --> Zn(s) + Br2(aq)
Wenn man nun die Spannungsquelle entfernt, läuft die Reaktion wieder in die andere Richtung
ab. Das Zink gibt Elektroden ab, welche über die Elektroden zum Brom fließen. Das Brom nimmt diese Elektronen auf, und es
entsteht wieder Zinkbromid.

